
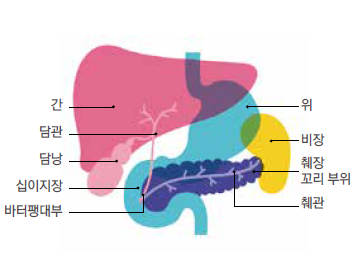
1. 췌장
- 복부에 있는 내분비 기관으로 복부 장기 중 위장 뒤에 위치, 명치 끝부분~복부 뒷부분까지 좌우로 15cm
- 머리, 몸통, 꼬리로 나누어 부르고 주변 중요 장기 및 혈관과 가깝게 위치함 --> 암 발생으로 인한 수술로 절제 필요한 경우 주변 장기 및 혈관이 다치지 않기 위해 많은 노력이 필요
- 머리 부분- 십이지장과 바로 인접, 췌장의 관(췌관)이 십이지장 안으로 열려있어 췌장에서 만들어진 여러 효소들이 십이지장으로 흘러 소화를 도움(간에서 만들어진 효소도 담관을 통해 십이지장 안으로 이동함)

2. 기능
- 소장 내 음식물 소화에 관여하는 소화 효소를 생성하여 췌관을 통해 십이지장으로 분비
- 혈당을 조절하는 인슐린 등의 호르몬 생산
3. 췌장암
머리, 몸통, 꼬리를 포함한 어느 부위에서나 암 덩어리가 자랄 수 있음
암세포의 특성에 따라 외분비 암종(exocrine tumor), 내분비 암종(endocrine tumor)으로 분류
- 외분비 암종(exocrine tumor): 췌장 내에서 효소를 생산하는 외분비 세포에서 암이 발생, 췌장암의 95%, 췌장관 샘 암(Pancreatic ductal adenocarcinoma)이 가장 많음
- 내분비 암종(endocrine tumor): 드물게(5%) 발생, 신경내분비 암(neuroendocrine tumor)라고도 함
4. 췌장암의 진단 및 병기
4.1. 진단
보통 초기에 증상이 별로 없는 경우가 많아 진행이 된 상태에서 진단되는 경우가 많음
진단 위해서는 다양한 검사가 필요-세포학적 특성(샘암, 신경 세포암) & 병이 퍼진 범위 확인 필요
- 세포학적 특성: 조직검사를 통해 확인
- 병의 범위: 영상 검사를 통해 확인
4.2. 병기(Stage)
췌장암 확진 시 필요. 향후의 치료방향 결정하는데 가장 중요한 요소가 됨
4.2.1. 병기 1기
- 가장 초기 상태, 암이 췌장 내에 국한, 전이되지 않아 수술을 통한 절제로 암 치료 가능
4.2.2. 병기 2기
- 암이 십이지장, 담관 등 췌장 주변 장기나 림프절로 퍼져 나가기 시작하는 단계
- 크게 퍼지지 않았으므로 수술을 통해 치료 가능
4.2.3. 병기 3기
- 암이 췌장 밖으로 퍼져 주위의 위장, 비장, 대장 및 췌장 주위를 지나가는 중요한 큰 혈관들까지 침범한 경우 암이 전신으로 퍼지지 않았기 때문에 국소적으로 진행된 암이라고 함
- 수술을 통해 제거하기에는 주변 장기를 광범위하게 제거해야 하므로 수술이 복잡, 성공률도 낮아 대부분 수술이 불가능
- 일부 경계성 절제 가능(borderline resectable) 췌장암: 광범위 절제를 통해 암의 완전 제거를 시도
- 위장, 비장 등의 장기 제거는 큰 어려움 없이 가능한 경우가 많으나 큰 혈관부는 암 침범 부위를 제거한 후 혈관 재건 수술로 복구해야 하므로 수술이 불가능한 경우가 많음, 따라서 수술 가능성을 판단하는 데 췌장 주변부의 큰 혈관 침범 정도가 가장 중요한 요소가 됨
4.2.4. 병기 4기
- 암세포가 몸 전체에 퍼져 나간 경우
- 진행성 혹은 전이성(metastatic) 췌장암
- 대부분 간에 전이, 이외에 폐, 림프절 등에 많이 전이됨
- 수술적 치료 불가능, 항암 화학요법을 통해 치료 시도
4.3. 췌장암의 특징
임상적인 병기 이외에 좀 더 구체적인 병기 설정 방법인 TNM 병기가 있음
T(원발종양 크기)
- T1: 암이 췌장 내 국한, 2cm 이내
- T2: 암이 췌장 내 국한, 2~4cm
- T3: 암이 주변 장기로 퍼졌으나 큰 혈관까지는 못 미침, 4cm 이상
- T4: 암이 췌장 주변 장기로 퍼져 주변 주요한 큰 혈관까지 침범
N(주변 림프절 침범 유무)
- N0: 췌장 주변부 림프절 침범하지 않음
- N1: 췌장 주변부 림프절 침범함
M(원격전이 유무)
- M0: 다른 장기로 퍼지지 않음
- M1: 간, 폐 등 다른 장기로 퍼짐
5. 췌장암 치료
5.1 수술적 치료
초기 췌장암인 경우 수술이 가장 효과적임 하지만 초기단계에서의 발견이 어렵기 때문에 약 8%의 환자만이 가능함
5.1.1. 췌장 절제술 대상 환자
- 절제 가능 암(resectable cancer): 췌장 이외의 부위로 암이 퍼지지 않은 경우, 수술을 받을 수 있는 건강한 전신상태인 경우
- 진행암(advanced cancer), 전이암(metastatic cancer): 수술 불가능 --> 암의 진행과 증상을 조절할 수 있는 다른 치료 필요
- 경계성 절제 가능 췌장암(borderline resectable pancreatic cancer): 주요 혈관에 매우 근접하나 수술적 절제를 고려하는 경우, 어떤 혈관인지 & 얼마나 떨어져 있는지에 따라 암 절제술 여부 결정, 암이 동맥 일부에 접해 있다면 항암 후 수술 가능 하지만 암이 동맥을 둘러싸고 자라는 경우 항암 이후라도 암 절제술 불가능
- 수술 전 항암 화학요법/항암방사선 요법: 경계성 절제 가능 췌장암 혹은 국소 진행성 췌장암의 경우 수술 전 암의 크기가 커서 완전 절제가 어려운 경우 수술 전 항암화학요법이나 항암방사선동시요법이 시도되는 경우가 있음
5.1.2. 수술의 장단점
- 장점: 암을 제거하는 가장 효과적인 방법으로 수명 연장 가능, 황달, 통증, 소화 장애 등 증상 일부 개선 가능, 재발 시 후속치료로 항암화학요법 등 실시할 수 있음
- 단점: 회복을 위해 1-2주 입원(연장될 수도), 통상적으로 회복까지 6개월 이상 소요, 소화장애 및 당뇨 등의 부작용 가능(수술하지 않아도 암으로 인해 발생 가능)
- 수술 관련 사항: 대부분의 췌장 절제술은 4-7시간 소요, 복부에 체액 배출을 위한 배출관을 두고 봉합하여 마무리함
5.2. 항암 화학요법
많은 췌장암 환자들이 근치적 절제 불가능한 상태에서 진단, 증상 없이 초기 발견되어도 수술 후 재발이 빈번함
5.2.1. 수술 후 항암 화학요법
췌장암 수술 후 보조적 항암 화학요법 치료를 받는 것이 생존율을 더 높이는 것이 증명됨
- 젬시타빈(gemcitabine): 수술 후 젬시타빈을 6개월 동안 투여한 환자군에서 통계적으로 유의한 무병 생존기간의 연장을 확인(2007년)
- 5-플루오로우라실(5-FU)/ 류코보린(leucovorin) 병합 투여군과 젬시타빈 투여군 비교: 전체 생존율에 차이 없음, 병합 투여군에서 부작용이 더 많이 발생함(2009년)
- 젬시타빈, 카페시타빈(Capecitabine)의 병합요법: 젬시타빈 단독 치료보다 병합요법으로 6개월간 치료하는 것이 효과가 우월하여 표준 치료로 사용됨(최근)
- 폴피리녹스(Folfirinox)요법: 수술 후 충분히 회복한 췌장암 환자에서 젬시타빈 단독 치료하는 것보다 폴피리녹스요법(5-플루오로우라실, 이리노테칸, 류코보린, 옥살리플라틴 병합치료)으로 6개월간 치료하는 것이 효과가 훨씬 우월한 것으로 확인되어 앞으로 표준치료로 사용될 가능성이 높음(2018년 발표)
- 환자의 건강상태가 병합요법 사용하기 어려운 경우: 젬시타빈 단독 혹은 5-플루오로우라실/류코보린 치료로 고려
- 수술 후 미세 잔존암 혹은 잔존암 의심 시 보조항암치료 전후로 항암방사선 동시 치료 추가를 고려
5.2.2. 수술 외 항암 화학요법 치료
진행성 / 전이성 췌장암 환자에서 전신 항암 화학요법은 증상의 완화 및 생존율 향상에 기여함
젬시타빈(Gemcitabine)
- 췌장암의 1차 항암화학요법
- 항대사성 약물에 속하는 항암제, 암세포가 자라는데 필요한 정상 세포 내 영양분과 비슷하나 암세포가 이 약을 받아들였을 때 암세포의 성장을 방해하는 작용을 함
- 췌장암 이외에도 비소세포 폐암, 방광암, 유방암, 난소암 등에 단독으로 또는 다른 항암제와 같이 사용
- 1997년 이후 젬시타빈을 기반으로 하는 항암 화학치료가 표준치료로 정립
젬시타빈(Gemcitabine)과 아브락산(Abraxane)의 병합요법
- 전이상 췌장암의 치료에서 표준 항암화학 치료로 권고
- 병합요법이 젬시타빈 단독 치료에 비해 효과가 좋은 것으로 밝혀짐(2013, 3상)
폴피리녹스(Folfirinox)요법
- 5-플루오루우라실(5-FU), 이리노테칸(irinotecan), 류코보린(leucovorin), 옥살리플라틴(oxaliplatin)항암제로 구성
- 폴피리녹스 항암화학치료와 젬시타빈 단독치료 효과 비교 시 폴피리녹스 치료가 더 우월한 치료효과 나타남(2011, 3상)
- 폴피리녹스 치료 환자군에서 젬시타빈 단독 치료 환자군에 비하여 부작용이 흔하게 발생
티에스원(TS-1)
- 항대사성 약물에 속하는 항암제
- 경구용 플루오로우라실 계열의 약제, 암세포가 이 약을 받아들였을 때 암세포의 성장을 방해하는 작용
- 국소진행성/전이성 췌장암 치료 시 티에스원 단독 치료가 젬시타빈 단독 치료와 비교하여 효과가 열등하지 않은 것으로 나타남
- 경구 항암제로서 치료의 편리성, 젬시타빈 치료에 비해 약한 부작용 --> 전신 수행 상태가 좋지 않거나 고령환자의 경우 병합치료하기 힘든 경우에 고려해 볼 수 있음
나노리포좀 이리노테칸, 오니바이드(Onyvide)
- 2차 항암치료
- 국소진행성 / 전이성 췌장암의 2차 항암 화학치료를 위한 표준요법은 확실히 정립된 치료가 없음(젬시타빈으로 1차 항암치료에 반응을 보이지 않는 환자/질병이 조절되다가 악화되는 환자의 경우 전신상태가 악화되어 2차 항암치료를 못하는 경우가 많아 대규모 3상 연구가 힘들기 때문)
- 오니바이드, 5-플루오로우라신, 류코보린의 병합요법이 5-플루오로우라신,류코보린 투여 환자군에 비하여 우수
- 전이성 췌장암의 치료에서 젬시타빈 기반 1차 항암 치료 이후 질병 악화되었으나 전신상태가 좋은 환자의 경우 오니바이드, 5-플루오로우라신, 류코보린의 병합치료를 표준치료로 권고할 수 있음
폴폭스(Folfox) 또는 젤록스(Xelox)
- 옥살리플라틴, 5-플루오로우라실 및 류코보린을 병합하는 항암치료
- 카페시타빈(Capecitabine, 젤로다정): 5-플루오로우라실의 전단계 전구물질로 경구 복용, 체내로 들어가면서 세포 내 효소에 의해 대사되어 5-플루오로우라실로 바뀌며 항암효과를 보임
- 진행성 췌장암의 2차 치료, 단독 치료 혹은 옥살리플라틴과 병합치료인 젤록스 요법으로 그 효과가 입증됨
- 젬시타빈 기반의 항암치료에 병이 진행한 국소진행형 혹은 전이성췌장암 환자에서 2차 치료로 폴폭스, 젤록스, 젤로다 단독 항암 치료를 사용해 볼 수 있음
표적항암제
- 엘로티닙: 특정 암세포와 일부 정상 세포의 표면에 발현되고 있는 단백질인 상피세포 증식인자(EGFR)를 표적으로 하여 종양 세포의 성장을 차단하도록 개발
- 젬시타빈과 엘로티닙 병용투여 시 생존율 증가 (0.3개월 연장)으로 실제 이득이 크지 않은 상태로 최근에는 폴피리녹스요법 혹은 젬시타빈/아브락산 병합 요법이 더 빈번히 사용됨
면역항암제
- PD-1을 억제하는 면역항암제가 폐암을 비롯한 다른 암에서 효과를 보였으나 췌장암에 효과적인 면역항암제는 개발되지 않았음
5.2.3. 항암 화학요법의 부작용
혈구 영향
- 혈구는 골수에서 만들어지는데 항암치료는 골수를 손상시켜 혈구 수가 일시적으로 감소할 수 있음, 치료 후 7-12일에 나타남
- 항암 화학요법 받는 동안 정기적으로 혈액검사 필요: 전체 혈구검사(Complete blood cell count, CBC)
- 백혈구 수치 감소: 감염위험,
- 적혈구 및 헤모글로빈 수치 감소: 빈혈
- 혈소판 수치 감소: 출혈 위험
기타 부작용
설사, 피로감, 오심 및 구토, 식욕감퇴, 미각 변화, 구내염 및 구강궤양, 탈모(납-파클리탁셀 이나 폴피리녹스 등에서 빈번), 혈전(심부정맥 혈전증), 말초신경염(손가락과 발가락 저림이나 무감각함)
5.3. 방사선요법
- 암세포를 파괴하기 위해 고에너지 X선(high-energy x-rays)을 사용하는 방법
- 상황에 따라 수술 전 암세포를 위축시킬 목적으로 권고되기도 함(일부 경계성 절제 가능 암)
- 수술 후 재발 가능성 줄이기 위해 사용하기도 함
'공부' 카테고리의 다른 글
| 악성 림프종 (0) | 2020.11.20 |
|---|---|
| 백혈병 (0) | 2020.11.19 |
| 암? 양성종양? 악성종양? 선암종? 육종?? 헷갈리는 종양의 명칭과 종류 (2) | 2020.09.21 |
| [코로나19] "엄마 코로나가 2단계가 됐대" (9) | 2020.08.20 |
| [코로나19] 러시아에서 세계 최초로 허가된 COVID-19 백신, 맞아도 되는건가요? (0) | 2020.08.14 |



